Новообразования, исходящие из эпителиальных компонентов вилочковой железы, именуют тимомой. Это гетерогенная группа органоспецифических опухолей, которые могут быть как доброкачественными, так и злокачественными.
На долю тимом приходится примерно пятая часть всех новообразований переднего средостения. Обычно эти опухоли доброкачественны, но до трети их имеют признаки злокачественности. Особенностью доброкачественных тимом может считаться их способность рецидивировать, расти инвазивно с внедрением в рядом расположенные органы, а также метастазировать. Эти признаки отличают злокачественные опухоли, но очень редко могут быть свойственны и доброкачественным процессам.
Заболевают тимомами обычно люди зрелого и пожилого возраста, пик заболеваемости приходится на 4-6 десятилетие жизни. Больше подвержены патологии лица с миастенией. Среди пациентов приблизительно одинаковое число мужчин и женщин, детей – не более 8%. Злокачественные разновидности опухоли чаще поражают мужчин 20-50 лет.
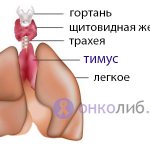
Тимус – это железа, расположенная в области переднего средостения, состоящая из двух долей и вырабатывающая гормоны внутренней секреции (тимулин, тимопоэтин). Кроме этого, железа играет иммунную роль, так как в ней образуются и созревают Т-лимфоциты.
У детей тимус играет важную координирующую роль между эндокринной и иммунной системами, а ко взрослому возрасту значение тимуса для организма ослабевает, он атрофируется и замещается жировой тканью. У пожилых людей тимус представлен жировой тканью и единичными островками железы.
Тимома средостения представляет большую опасность ввиду врастания и компрессии соседних органов, поэтому своевременное удаление опухоли – первостепенная задача в лечении.
Причины развития Тимом
Как и почему возникает опухоль, исходящая из вилочковой железы, неизвестно. Однако опухоль тимуса была достоверно связана с различными системными синдромами. 30-40% пациентов с тимомой испытывают симптомы, связанные с миастенией гравис (myasthenia gravis). Еще 5% пациентов с тимомой имеют другие системные синдромы, включая:
- эритроцитарную аплазию;
- дерматомиозит;
- системную красную волчанку (SLE);
- синдром Кушинга;
- синдром несоответствующей секреции антидиуретического гормона (SIADH).
Значимые для других онкопатологий, таких как рак легких или рак шейки матки факторы риска для опухолей вилочковой железы также не определены.
Симптоматическая картина
Симптомы заболевания различны для типов опухолей, размеров очага и степеней поражения отдельных тканей. Для новообразований маленького размера характерно скрытое течение болезни. Узлы обнаруживаются случайно, когда грудина просвечивается на рентгене при других заболеваниях. Латентный период длится долго. Время развития зависит от клеточного состава опухоли.
Клиника злокачественных узлов характеризуется быстрым развитием болезни и выраженными симптомами. Гиперплазия поражённых тканей провоцирует нарушения в работе других органов. Больной испытывает:
- Одышку;
- Ощущение постороннего предмета в груди;
- Боли при кашле;
- Невозможность вдохнуть полной грудью;
- Давление на часть пищевода затрудняет проглатывание пищи.
Объёмные новообразования сдавливают верхнюю полую вену. Полноценный отток венозной крови невозможен, поэтому пациент отмечает:
- Отечность верхней части тела;
- Одутловатость лица;
- Расширение и уплотнение вен шеи;
- Синий оттенок кожных покровов;
- Боли при кашле и глубоком вдохе;
- Шум в голове.
Болезненные ощущения возникают со стороны расположения узла и распространяются в руку. Часто патологию принимают за сердечные нарушения при боли в левой руке. Отмечается обильное потоотделение и нарушение терморегуляции. Возможно развитие птоза и нарушение зрительных функций.
Если поражен гортанный нерв, возникают отклонения в голосе вплоть до полного исчезновения. Давление на нервные корешки позвоночника проявляется онемением участков тела и снижением двигательных функций.
Ослабление дыхательных мышц, туловища и диафрагмы вызвано производимыми тимусом антителами. Нарушения характерны для пациентов с аутоиммунными патологиями. Развивается миастения. Больные ощущают:
- Мышечную слабость;
- Першение в груди;
- Утомляемость при любой физической нагрузке, даже при ходьбе;
- Мышцы лица не выражают эмоций;
- При развитии миастенического криза больной не может самостоятельно дышать.
Рак на поздних этапах развитиях проявляется общими симптомами интоксикации:
- Снижение массы тела;
- Повышение температуры;
- Тошнота и рвота;
- Повышенная потливость;
- Отвращение к пище;
- Боли и ломота в теле;
- Отёк конечностей;
- Кровотечения;
- Аритмия.
Признаки и симптомы
Опухоль вилочковой железы — симптомы может не вызывать вообще. Лишь у одной трети присутствуют местные симптомы, связанные с вторжением опухоли в окружающие структуры. Эти пациенты могут иметь:
- кашель,
- боль в груди,
- синдром верхней полой вены (SVC),
- дисфагию и хрипоту, если вовлечен возвратный гортанный нерв.
Треть случаев обнаруживается случайно при рентгенографических исследованиях во время обследования на миастению гравис (MG).
Хотя развитие тимомы в детстве встречается очень редко, симптомы у детей, напротив, проявляются чаще и ярче, чем у взрослых.
Было предложено несколько объяснений распространенности симптомов у детей.
- У детей тимома чаще имеет злокачественное течение (рак вилочковой железы).
- У ребенка меньше полость средостения, поэтому опухоли чаще вызывают симптомы компрессии или инвазии.
- Наиболее распространенное место возникновения опухолей средостения у детей — около трахеи, что и приводит к респираторным симптомам
Причины возникновения тимомы
Причины возникновения тимомы неизвестны. Предполагается, что в этом процессе могут принимать участие следующие факторы:
- Нарушения в эмбриональном периоде развития.
- Нарушение синтеза тимопоэтина.
- Нарушение иммунных механизмов.
- Инфекционные заболевания.
- Воздействие ионизирующего излучения.
- Травматические повреждения органов средостения.
- Некоторые аутоиммунные и эндокринные патологии: синдром Иценко-Кушинга, диффузный токсический зоб, миастения и др.
Запись на консультацию круглосуточно
+7 (495) 151-14-53
Классификация
Четкого гистологического различия между доброкачественными и злокачественными тимомами не существует. Склонность тимомы к злокачественности определяется ее инвазивностью. Злокачественные тимомы могут поражать сосудистую сеть, лимфатические узлы и соседние структуры в средостении. 15-летняя выживаемость составляет 12,5% для человека с инвазивной тимомой и 47% для человека с неинвазивной тимомой.
В зависимости от гистологических показателей, выделяют:
- Тип A — Медуллярная тимома
- Тип AB — Смешанная тимома
- Тип B1— Преимущественно корковая тимома.
- Тип B2 — Корковая тимома.
- Тип B3 — Хорошо дифференцированная карцинома тимуса.
- Тип C — Тимусная карцинома.
AB и B2 — наиболее распространенные виды тимомы, а тип A встречается очень редко. Если тип A постепенно переходит в C, перспективы выживания, как правило, ухудшаются. Лучший прогноз имеет тип A, худший — C.
Причины для обращения к врачу
Помимо планового приема, необходимость посетить хирурга возникает при появлении таких симптомов:
- сильная боль за грудиной;
- отечность, покраснение послеоперационной раны, появление отделяемого;
- внезапное повышение температуры тела;
- признаки тромбоза вен – отек, распирающая боль в ноге, изменение цвета кожи.
Нарастание мышечной слабости, затруднения при глотании, жевании, опущение века, нарушения зрения являются поводом для визита к невропатологу для пересмотра дозы принимаемых медикаментов. При приступах кашля, одышки, боли в грудной клетке на фоне лихорадки нужен осмотр терапевта, обследование для исключения послеоперационной пневмонии, медиастинита.
Стадии
Наиболее распространенная система стадирования тимом — Система Масаока.
| Стадия | Определение | Лечение |
| Стадия 1 | Инкапсулированная опухоль без грубого или микроскопического проникновения | Полное хирургическое удаление |
| Стадия 2 | Макроскопическая инвазия в средостение жира или плевры или микроскопическая инвазия в капсулу | Полное хирургическое иссечение и послеоперационная лучевая терапия для снижения частоты местных рецидивов |
| Стадия 3 | Инвазия перикарда, больших сосудов или легких | Полное хирургическое иссечение и послеоперационная лучевая терапия для снижения частоты местных рецидивов |
| Стадия 4А | Плевральное или перикардиальное метастатическое распространение | Хирургический дебуллинг, лучевая терапия и химиотерапия |
| Стадия 4B | Плевральное или перикардиальное метастатическое распространение | Хирургический дебуллинг, лучевая терапия и химиотерапия |
Уход после удаления тимуса
Уход в больнице
Через капельницу будут вводиться необходимые жидкости и лекарства. Вы будете проинструктированы, как практиковать глубокое дыхание и кашель, для очистки легких. Медсестра будет измерять силу мышц и дыхание, чтобы определить эффективность операции.
Уход на дому
Время восстановления зависит от степени заболевания пациента. Восстановление может занять всего 1-2 недели, но иногда требуется около трех месяцев, прежде чем вы сможете вернуться к работе или учебе. Спросите врача, когда безопасно принимать душ, купаться, или подвергать место операции воздействию воды. Обязательно следуйте указаниям врача.
Если операция была сделана для лечения миастении:
- Восстановление мышечной силы может занять от нескольких месяцев до нескольких лет;
- Важно работать с неврологом в период выздоровления, чтобы регулировать прием лекарственных средств.
Диагностика
В диагностике тимом используются современные средства медицинской визуализации.
- Компьютерная томография (КТ) — позволяет получить серию изображений внутренней части тела, сделанных на разных глубинах и под разными углами. Она обеспечивает более высокий уровень детализации, чем при рентгенографии грудной клетки. Для получения детального отображения сосудов средостения используется КТ с введением рентгеноконтрасного вещества.
- Магнитно-резонансная томография (МРТ), в которой детальные изображения внутренних органов и тканей создаются с использованием магнитного поля способна достаточно детально отобразить структуры тканей тела.
- Позиционная эмиссионная томография (ПЭТ-сканирование), которая определяет, с какой интенсивностью клетки используют глюкозу. Опухолевые клетки метаболически более активны (растут быстрее, чем нормальные клетки) и поэтому поглощают больше глюкозы. Области повышенного поглощения глюкозы, обнаруженные при сканировании ПЭТ, могут указывать на злокачественность.
Последствия, с которыми можно столкнуться
В раннем послеоперационном периоде возможно кровотечение и загрудинная гематома. Они могут потребовать повторной операции. При использовании открытого доступа с рассечением грудины отмечаются:
- инфицирование раны, подкожной клетчатки;
- воспаление средостения (пространства между грудной клеткой, легкими, крупными сосудами);
- нагноение костной ткани грудины (остеомиелит).
Для их предотвращения назначают антибиотики. Менее травматичной считается эндоскопическая операция, при ней гнойно-воспалительные осложнения бывают реже.
Вне зависимости от метода удаления содержимое тимуса может попасть в кровь. Это вызывает ухудшение проявлений миастении, развивается криз. Он требует немедленной искусственной вентиляции легких. Для предупреждения такого осложнения до и после операции вводят Прозерин, Галантамин.
Медленное заживление раны, склонность к нагноению отмечены у пациентов, которым до удаления железы были назначены высокие дозы Преднизолона. При очистке крови методом гемосорбции (введение специальных препаратов от ядовитых веществ) бывает повышенная склонность к кровотечениям. В ходе предоперационной подготовки таким больным снижают дозу гормона, корректируют свертывающую способность крови.
Лечение
Хирургические подходы к тимоме
Удаление вилочковой железы называется тимэктомией. Различные операционные подходы, часто продиктованные размером и расположением опухоли, используются для удаления тимом и рака вилочковой железы.
- Срединная стернотомия — вскрытие грудины по средней линии, чтобы получить доступ к средостению для частичного или полного удаления опухоли.
- Торакальная хирургия с использованием видео (VATS) — использование небольшой камеры и специально разработанных эндоскопических инструментов, вводимых в небольшие разрезы между ребрами для работы внутри грудной клетки и удаления тканей, избегая торакотомии.
- Торакальная хирургия с помощью роботов — использует роботизированное устройство для маневрирования хирургических инструментов, вводимых в небольшие разрезы между ребрами, как и VATS. Но робот позволяет хирургам работать с большей точностью. Поэтому роботизированные операции эффективнее и безопаснее.
Химиотерапия
Потенциальные кандидаты на химиотерапию включают примерно одну треть пациентов с раком вилочковой железы, который позже метастазирует, и всех пациентов с болезнью IV стадии.
Различные схемы введения цисплатина, винкристина ,доксорубицина или циклофосфамида чаще всего используются при не полностью резецированных инвазивных тимомах или в случаях с неоперабельным заболеванием. Общий средний ответ на химиотерапию составляет 90% при среднем времени выживания 15 месяцев.
Исследование, проведенное Европейской организацией по исследованию и лечению рака (EORTC) в Бельгии, показало, что среди 16 пациентов с рецидивирующими или метастатическими тимомами наблюдались пять полных ремиссий и четыре частичных ремиссии при использовании химиотерапии. Медиана выживаемости в этом исследовании составила 4,3 года.
Лучевая терапия
Адъювантная лучевая терапия при полностью или не полностью резецированных тимомах III или IV стадии считается стандартом лечения. Однако использование послеоперационной лучевой терапии при тимомах II стадии в Европе сейчас не используется, так как доказано, что возможный вред от такого подхода превышает возможную пользу.
Другие методы терапии — комплексная гормонотерапия
Агрессивное мультимодальное гормональное лечение показало себя очень эффективным и способным справляться с местнораспространенными, неоперабельными и злокачественными тимомами.
Октреотид (синтетический аналог соматостатина) в дозе 0,5 мг каждые 8 ч можно использовать отдельно или с преднизоном (0,6 мг/кг/день). Комплекс Октреотид + преднизон дает лучшую выживаемость без прогрессирования заболевания, чем только октреотид.
Октреотидная терапия может быть ценным вариантом лечения, когда химиотерапия неэффективна.
Перспективные варианты лечения — молекулярно-таргетная терапия
Последние исследования выявили конкретные молекулярные изменения в тимомах, которые могут стать мишенями для таргетной терапии. В одном исследовании 10 из 12 тимом показали экспрессию рецептора эпидермального фактора роста (EGFR). Эта информация будет полезна при отборе пациентов, которым могут быть полезны ингибиторы EGFR в рамках схемы лечения. Другие области исследования включают маркеры, связанные с апоптозом, такие как p63, член семейства p53. Этот маркер экспрессируется практически во всех тимомах. Дальнейшие исследования, касающиеся биологии тимом, позволят более адекватно подходить к лечению.
В настоящее время в Европе и уже действуют программы по клиническим исследованиям этих перспективных методик.
Торакоскопическое удаление вилочковой железы при миастении у детей
Начало миастении возможно в любом возрасте: описаны врожденные формы, а также начало болезни в возрасте 70-80 лет [1,6].
Исходя из известных аспектов патогенеза миастении, были разработаны и внедрены в практику такие способы лечения как лучевая терапия вилочковой железы, гормонотерапия, тимэктомия, применение иммунодепрессантов и эфферентного лечения [5,8]. В последние годы увеличивается количество публикаций, определяющих тимэктомию как один из наиболее эффективных методов лечения миастении [7,11,13].
В международной практике тимэктомия при миастении всегда сопровождается удалением диафрагмальной клетчатки, прилегающей к вилочковой железе с целью исключения возможности оставления участков эктопированной тимической ткани. Стернотомический доступ считался оптимальным для выполнения данного вмешательства [14], однако его высокая травматичность и, как следствие, тяжело протекающий ближайший послеоперационный период, а также достаточно высокий процент гнойных осложнений являются существенными недостатками указанного доступа [12].
Новые технологии и стремление к малоинвазивности в современной хирургии изменили взгляды на технику выполнения тимэктомии, и традиционные методы операции постепенно уступают свое место эндохирургическим вмешательствам [1,3]. Многие зарубежные авторы считают торакоскопическую тимэктомию оптимальным методом лечения при миастении, как у взрослых, так и у детей, поскольку отмечают хорошие клинические результаты, быстрое восстановление больных после вмешательства, меньше послеоперационных осложнений и хороший косметический эффект [4,5,11].
Материал и методы
За период с 2004 по 2012гг. в отделении торакальной хирургии ГБУЗ ДГКБ №13 им. Н.Ф. Филатова ДЗМ Москвы видеоторакоскопическая тимэктомия (ВтТ) была выполнена 32 больным с генерализованной формой миастении. Возраст пациентов составил от 5 до 21 года (13±3), мальчиков было 6 (19%), девочек – 26 (81%).
Диагноз миастения ставился на основании клинических проявлений, прозериновой пробы, электромиографии и определения титра антител к ацетилхолиновым рецепторам (АХР). Состояние больных оценивалось по классификации американского фонда миастении:
I. -изолированная слабость окулярных мышц любой выраженности;
II. а — преобладание легкой слабости мышц туловища, либо проксимальных отделов конечностей, либо того и другого. Также может быть умеренное вовлечение в процесс краниобульбарных мышц; IIb- преобладание слабости краниобульбарных и/или дыхательных мышц. Возможно умеренное вовлечение мышц туловища, либо проксимальных отделов конечностей, либо того и другого;
III. а — преобладание средней степени слабости мышц туловища, либо проксимальных отделов конечностей, либо того и другого. Также может быть умеренное вовлечение в процесс краниобульбарных мышц; IIIb- преобладание средней слабости краниобульбарных и/или дыхательных мышц. Возможно умеренное вовлечение мышц туловища, либо проксимальных отделов конечностей, либо того и другого;
IV. a — преобладание тяжелой степени слабости мышц туловища, либо проксимальных отделов конечностей, либо того и другого. Также может быть умеренное вовлечение в процесс краниобульбарных мышц;IVb- преобладание тяжелой степени слабости краниобульбарных и/или дыхательных мышц. Возможно умеренное вовлечение мышц туловища, либо проксимальных отделов конечностей, либо того и другого;
V. — кризисные состояния (интубация с или без механической вентиляции, использование зондового питания без интубации у пациентов группы IVb).
По клиническим проявлениям больные относились к группам IIb -IVb и получали антихолинэстеразные и гормональные препараты. Показания к операции ставились сотрудниками Московского миастенического центра на основании неэффективности консервативной терапии, средний срок которой составил 19,5±18 месяцев. В протокол дооперационного обследования входили: рентгенография грудной клетки в двух проекциях, УЗИ грудной и брюшной полости, ЭКГ, ЭхоКГ, клинические анализы крови и мочи, биохимический анализ крови. Для выявления возможного опухолевого поражения вилочковой железы (тимома) пациентам выполнялась компьютерная томография грудной клетки. Для определения тактики ведения больных в предоперационном периоде проводилась консультация невролога. 31 (97%) больной оперирован на фоне полной или неполной медикаментозной ремиссии, одна (3%) больная оперирована на высоте миастенического криза.
При ВтТ у 22 (69%) детей старшего возраста применяли однолегочную вентиляцию обычной интубационной трубкой с использованием фиброоптической интубации, которая в достаточной мере обеспечивает полезное рабочее пространство, а также дополнительный объем для манипуляций в плевральной полости и средостении. У 10 (31%) детей использовали стандартную вентиляцию легких, на этапе освоения техники операции и фиброоптической интубации.
В исследуемой группе больных оценивали следующие показатели: длительность ИВЛ, длительность операции, длительность пребывания в отделении реанимации, длительность приема обезболивающих препаратов, интраоперационные и послеоперационные осложнения, количество дней, проведенных пациентом в стационаре после оперативного вмешательства.
Результаты оценивали по общепринятой шкале G. Keynes, где клинически полное выздоровление оценивается как эффект А; стойкая ремиссия при значительном уменьшении дозы антихолинэстеразных препаратов — эффект В; улучшение состояния на фоне прежнего количества антихолинэстеразных препаратов — эффект С; отсутствие улучшения состояния — эффект D; летальный исход – эффект Е.
Статистические расчеты выполнены на персональном компьютере с использованием приложения Microsoft Excel и пакета статистического анализа данных Statistica 5.1 for Windows (Stat Inc.,USA).
Техника ВтТ
Операция выполнялась из право или левостороннего доступа. Положение больных при удалении вилочковой железы на спине с подложенным валиком на стороне оперативного вмешательства (рис. 1).
Рис. 1
Использовались 4 торакопорта диаметром от 3,5-10мм в зависимости от возраста пациента. Первый троакар (диаметр 10 мм) для телескопа устанавливали в V межреберье по среднеподмышечной линии. После установки первого троакара начинали инсуффляцию СО2 в плевральную полость под давлением 6 8 мм рт.ст. Затем устанавливали остальные троакары диаметром 3,5–6 мм для манипуляторов по средне или заднеподмышечной линиям в IV и VII межреберьях (рис. 2).
Рис. 2
Первым этапом операции является ревизия плевральной полости и средостения с целью определения наличия спаечного процесса, оценки топографо-анатомических соотношений органов средостения, выявления опухолевого поражения тимуса. Следующим этапом является вскрытие медиастинальной плевры над тимусом, которая обычно отделяется легко (рис. 3).
Рис. 3
Этот этап операции выполняли с использованием монополярного коагулятора. Выделяли нижние рога вилочковой железы, тимус захватывали атравматическим зажимом и начинали диссекцию тканей в направлении шеи. Сперва выделяли правую долю тимуса, затем из той же плевральной полости мобилизовали левую долю железы при помощи атравматичных зажимов типа Babcock и Kelly, диссекторами и эндохирургическим тупфером (рис. 4).
Рис. 4
Во время диссекции использовали монополярную коагуляцию или коагулятор системы BiClamp. Сосуды, кровоснабжающие вилочковую железу, при невозможности использования коагуляции ввиду большого диаметра или нежелательных термических воздействий на окружающие ткани, клипировали при помощи эндоскопических клипаппликаторов, титановыми (Кarl Storz, Germany) и пластиковыми клипсами системы Hem-o-Lok (Teleflex, USA). Диссекцию продолжали до шейного отдела с целью удаления верхних рогов железы. Железу удаляли полностью. После удаления тимуса удаляли также диафрагмальную клетчатку, с целью исключения возможности оставления эктопированной тимической ткани. Удаленную вилочковую железу погружали в эндоконтейнер и извлекали из плевральной полости через отверстие 10мм троакара или расширенное до 1-2 см отверстие одного из троакаров. На последнем этапе плевральную полость промывали и оставляли дренажную трубку.
Результаты и обсуждение
Конверсии при ВтТ не было ни в одном случае. Интра и послеоперационных осложнений, летальных исходов не было. Длительность операций составила от 77±23 минут.
После операции 26 (81,3%) пациентов экстубированы на операционном столе и переведены в палату интенсивной терапии. На этапе освоения техники ВтТ и послеоперационного ведения 5 (15,6%) больных были экстубированы через 3-6 часов после операции в отделении реанимации и интенсивной терапии. Одна (3,1%) пациентка нуждалась в продленной ИВЛ в течение 7 дней, поскольку была оперирована на высоте миастенического криза. Следует отметить, что в данном случае у больной наблюдалась наиболее тяжелая форма миастении (4B).
В связи с малой травматичностью ВтТ минимальная активизация детей, перенесших удаление вилочковой железы торакоскопическим способом, стала возможной через 6-8 часов после операции, а полная- на 1-е сутки после операции.
У больных, перенесших ВтТ, в день операции и на 1-е сутки боли носили умеренный и слабый характер, а со 2-х суток были слабыми или отсутствовали. Наркотические анальгетики не применяли. Длительность дренирования плевральной полости во всех случаях составила 1 сутки. Длительность послеоперационного пребывания в стационаре составила от 3 до 9 (6±3) дней.
Сроки наблюдения за пациентами, оперированными эндоскопическим методом, составили от 6 месяцев до 8 лет. По шкале G.Keynes эффект А получен у 6 (25%) больных, эффект B у 20 (62,5%), эффект C у 2 (6,25%), эффект D у 2 (6,25%)детей. Эффект Е – 0%.
У всех пациентов получен отличный косметический результат. Из представленного рис. 2 видно, что у больного после ВтТ на грудной стенке определяются только следы после введения торакопортов (рис. 5).
Рис. 5
При выполнении тимэктомии торакоскопическим способом объем операции должен соответствовать аналогичной операции, выполняемой из стернотомического доступа, для достижения максимального клинического эффекта [4,9]. Также ВтТ должна выполняться в соответствии с классическими принципами торакальной хирургии детского возраста [1,10].
Основными моментами торакоскопических операций являются:
- правильное положение больного на операционном столе (картинка),
- расположение операционной бригады,
- рациональное расположение троакаров,
- использование оптики и инструментов малого диаметра.
Принебрежение хотя бы одним их этих принципов может значительно затруднить течение всей операции и неблагоприятно повлиять на исход лечения.
При тимэктомии оптимальное положение больного на спине с приподнятым боком на стороне операции на 20-300. Такая укладка больного дает возможность наиболее рационально расположить троакары для операции в переднем средостении, также эта позиция пациента полностью исключает вероятность смещения интубационной трубки при однолегочной вентиляции.
Средняя продолжительность операции при ВтТ намного меньше, чем при отрытых вмешательствах, что обусловлено отсутствием необходимости выполнения торакотомии, вследствие чего сокращается период для осуществления доступа к операционному полю, уменьшается длительность гемостаза, отсутствует необходимость ушивания торакотомной раны [8]. Так для разреза и последующего послойного ушивания грудной стенки при стандартной торакотомии требуется от 20 до 40 минут, при торакоскопии на это уходит от 3 до 5 минут. Другим важным преимуществом торакоскопического вмешательства является использование видеооборудования высокой четкости, которое позволяет правильно оценить соотношение органов средостения и более прецизионно выполнить диссекцию вилочковой железы. При извлечении удаленной вилочковой железы из плевральной полости удобно использование эндоконтейнера, который позволяет в большинстве случаев удалить препарат с минимальным повреждением или, при необходимости, предварительно фрагментировать его хирургическими ножницами непосредственно в просвете эндоконтейнера.
Малая травматичность операции и правильно подобранное анестезиологическое пособие позволяют экстубировать больных на операционном столе, и исключить необходимость продленной ИВЛ после операции. Минимальная активизация детей в таком случае происходит рано, поскольку больные сразу после операции переводятся в интенсивную палату в отделении хирургии, где могут находиться вместе с родителями, что имеет важное психологическое значение. Активизация больных также во многом зависит от слабо выраженного болевого синдрома, что исключает необходимость применения наркотических анальгетиков.
Прецизионная диссекция органа и малотравматичность способствуют завершению операции с минимальной кровопотерей, что и определяет низкую частоту послеоперационных осложнений в виде кровотечения. Низкая вероятность кровотечения позволяет удалить дренаж на первые сутки после операции, позволяя полностью активизировать больного.
К преимуществам эндоскопического удаления вилочковой железы вследствие меньшей операционной травмы относятся:
- нахождение больного в раннем послеоперационном периоде в интенсивной палате хирургического отделения и тем самым создание возможности контакта оперированных детей с родителями, что имеет положительное воздействие на психологическое состояние;
- активизация больных через несколько часов после операции;
- сокращение продолжительности дренирования плевральной полости;
- возможность кормления детей в день операции;
- исключение необходимости использования наркотических анальгетиков;
- значительное уменьшение пребывания больных в стационаре после операции.
Анализ больных показал, что при ВтТ возможно выполнение операции в полном объеме: удаление вилочковой железы и прилегающей к ней диафрагмальной клетчатки. Параллельно освоению техники операции совершенствуются методы проведения анестезии при ВтТ больным с генерализованной формой миастении. Благодаря ВтТ, оперированные больные переводятся в хирургическое отделение, минуя отделение реанимации, поскольку не возникает необходимости в продленной ИВЛ, сокращается срок пребывания детей в стационаре, понижается вероятность развития осложнений, связанных с основным заболеванием, а также в связи с малой травматичностью операции.
Заключение
В последние годы выполнение большинства хирургических вмешательств в детской торакальной хирургии стало возможным посредством эндоскопического метода, и торакоскопические операции по праву занимают ведущие позиции при лечении заболеваний органов грудной полости.
Таким образом, на основании проведенного анализа результатов хирургического лечения детей с генерализованной формой миастении, можно сделать следующее заключение: торакоскопическая тимэктомия дает возможность выполнить операцию по объему полностью соответствующую критериям аналогичной операции, выполняемой из открытого доступа; результаты лечения больных не отличаются от таковых у больных, оперированных классическим способом, и достоверно лучше по основным показателям (тяжесть послеоперационного периода и исходы лечения). После ВтТ отмечается менее выраженный болевой синдром, раннее восстановление активности, быстрое расправление легкого, максимально короткие сроки дренирования плевральной полости, отличный косметический результат. Исходя из вышесказанного можно смело сказать, что торакоскопическая тимэктомия является операцией выбора при хирургическом лечении генерализованной формы миастении у детей.
Литература
- Ветшев П.С., Шкроб О.С., Заратьянц О.В. и соавт. Диагностика и хирургическое лечение генерализованной миастении у детей. Хирургия. 1991, 12, с. 74-80-5.
- Заривчацкий М.Ф., Богатырев О.П., Блинов С.А. и др. Хирургия органов эндокринной системы. Ростов на Дону: Феникс, 2006, с. 131-149.
- Никитенко А.И., Желаннов А.М., Пузанков А.В. и др. Видеоторакоскопическая тимэктомия в лечении миастении. Техника и первые результаты. Эндоскопическая хирургия. 2001, № 2, с. 44-45.
- Пелюховский C.B. Применение видеоторакоскопии при хирургическом лечении генерализованной миастенией. Клин. хир. 2002, №8, с.23-24.
- Романова Т.В., Белякова М.Ю., Пушкин С.Ю. и соавт. Оценка эффективности тимэктомии у пациентов с миастенией. Саратовский научномедицинский журнал, 2009, т. 5, № 2, с. 234–237.
- Шевченко Ю.Л., Ветшев П.С., Ипполитов Л.И. и др. Сорокалетний опыт хирургического лечения генерализованной миастении. Хирургия. 2004,№ 5, С.32-38.
- Clarke C.P. et al., The evolution of surgery for myasthenia gravis. ANZ J. Surg. 2002. Jan; 72(1): P. 1
- Jaretzki A 3rd., Steinglass K.M., Sonett J.R. Thymectomy in the management of myasthenia gravis Semin Neurol. 2004. Mar; 24(1): P.49-62.
- Kogut K.A., Bufo A. J., Rothenberg S., Lobe T. Thoracoscopic thymectomy for myasthenia gravis in children. Pediatric Endosurgery and Innovative techniques 2001, V.5, №(2), P. 20-22.
- Kolski H.K. et al., Videoassisted thoracoscopic thymectomy in juvenile myasthenia gravis, J CHILD NEU, 16(8), 2001, p. 569-573
- Popescu I., Tomulescu V., Ion V., Tulbure D. Thymectomy by thoracoscopic approach in myasthenia gravis Surg Endosc. 2002. Apr; 16(4): P.679-684.
- Venuta F., Rendina E.A., De Giacomo T. et al. Thymectomy for myasthenia gravis: a 27year experience. Eur. J. Cardiothorac Surg. 1999. May; 15(5): P.621-624.
- Yim A., Low J.M., Ng K., et al: Videoassisted thocoscopic surgery in the pediatric population. J. Pediatr. Child. Health., 31:192-196, 1995.
- Zahid I., Sharif S., Routledge T. and Scarci M. Videoassisted thoracoscopic surgery or transsternal thymectomy in the treatment of myasthenia gravis? Interact. CardioVasc. Thorac. Surg., 2011;12:40-46.
Реабилитация и профилактика
Реабилитация может потребоваться после масштабной операции с торакотомией. Но такие операции при удалении тимом за рубежом уже практически не используются. Также реабилитационных мероприятий могут потребовать осложнения после лучевой терапии, например, лучевой перикардит, лучевой пневмонит или легочный фиброз.
В этих случаях после лечения собственно тимомы назначается реабилитационное лечение осложнений.
Первичная профилактика тимом не разработана, так как причины заболевания не выяснены. Профилактические мероприятия в виде долгосрочного мониторинга необходимы для предотвращения рецидива злокачественной тимомы.
Растут такие опухоли медленно, и рецидив после первичной терапии может наступить через 10-20 лет. Следовательно, долгосрочное наблюдение должно продолжаться в течение всей жизни пациента.
Есть ли противопоказания
Тимэктомию не проводят в таких ситуациях:
- наличие нерезектотельной тимомы, метастазы;
- сложные соматические патологии;
- повышенные дозировки антихолинэстеразных препаратов и кортикостероидных гормонов.
Операцию не проводят при глазных разновидностях миастении. Это обусловлено отсутствием эффекта от такого вмешательства.
Также целесообразность проведения хирургического вмешательства напрямую зависит от возрастной категории пациента. Обычно процедуру выполняют с подросткового возраста до 60 лет. Именно в этом возрастном диапазоне достигаются максимальные результаты.
Выживаемость пациентов и прогноз
Наиболее благоприятный прогноз заболевания ставят пациентам с доброкачественными тимомами:
- медуллярная и кортико-медуллярная — выживаемость 90-100% в течение 15 лет;
- кортикальная типа В1 — 90% в течение 20 лет;
- кортикальная типа В2 — выживаемость 60% за 20 лет;
- эпителиальная — в течение 20 лет выживают 40% пациентов.
После удаления злокачественной тимомы на начальной стадии в течение 5 лет выживают 90% больных. Операция на 3 стадии снижает шансы в среднем до 50%.
Продолжительность жизни при неоперабельной опухоли не составит 5 лет в 90% случаев.
Новообразования, исходящие из эпителиальных компонентов вилочковой железы, именуют тимомой. Это гетерогенная группа органоспецифических опухолей, которые могут быть как доброкачественными, так и злокачественными.
На долю тимом приходится примерно пятая часть всех новообразований переднего средостения. Обычно эти опухоли доброкачественны, но до трети их имеют признаки злокачественности. Особенностью доброкачественных тимом может считаться их способность рецидивировать, расти инвазивно с внедрением в рядом расположенные органы, а также метастазировать.
Заболевают тимомами обычно люди зрелого и пожилого возраста, пик заболеваемости приходится на 4-6 десятилетие жизни. Больше подвержены патологии лица с миастенией. Среди пациентов приблизительно одинаковое число мужчин и женщин, детей – не более 8%. Злокачественные разновидности опухоли чаще поражают мужчинлет.
Тимус – это железа, расположенная в области переднего средостения, состоящая из двух долей и вырабатывающая гормоны внутренней секреции (тимулин, тимопоэтин). Кроме этого, железа играет иммунную роль, так как в ней образуются и созревают Т-лимфоциты.
У детей тимус играет важную координирующую роль между эндокринной и иммунной системами, а ко взрослому возрасту значение тимуса для организма ослабевает, он атрофируется и замещается жировой тканью. У пожилых людей тимус представлен жировой тканью и единичными островками железы.

Тимома средостения представляет большую опасность ввиду врастания и компрессии соседних органов, поэтому своевременное удаление опухоли – первостепенная задача в лечении.